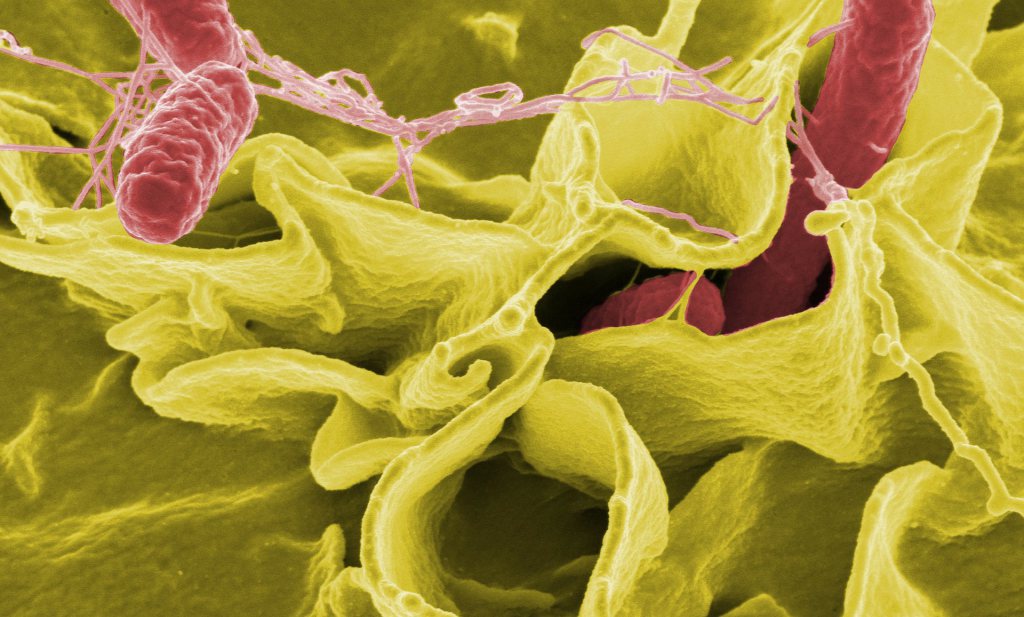
Onderzoekers van de KU Leuven hebben daar een oplossing voor. Ze ontdekten een manier waarop samenwerkende bacteriën van elkaar kunnen worden gescheiden. Het wetenschappelijke tijdschrift Nature publiceerde vorige week de resultaten.
De wetenschappers ontdekten dat de biofilm zowel in het voor- als in het nadeel voor de bacteriën kan werken. Door een zogenaamde slijm-remmer toe te dienen, kunnen de bacteriën hun beschermende laag niet opbouwen. Zo verliezen ze hun gebundelde krachten. “Zonder hun beschermende biofilm worden de bacteriën weggespoeld door mechanische krachten en kunnen ze makkelijker gedood worden door antibiotica, ontsmettingsmiddelen of het immuunsysteem”, zegt professor Hans Steenackers, hoofdauteur van de studie, op Knack.
Bovendien kan zich – in tegenstelling tot bij antibiotica – geen resistentie vormen tegen deze strategie, omdat de niet-resistente bacteriën de resistente wegconcurreren. De resistente bacteriën zullen namelijk veel harder moeten werken om een slijmlaag van dezelfde proportie te produceren als de niet-resistente bacteriën niet meewerken.
Het Leuvense onderzoek geldt nu al als een mijlpaal omdat de resistentie tegen antibiotica kan oplossen. Steenackers: “Ons doel is om deze nieuwe antimicrobiële stoffen in de klinische praktijk te introduceren. Ze kunnen worden gebruikt als een preventief medicijn in de vorm van een pil, of als een coating op implantaten om het risico op infecties te verminderen.” De stof kan ook samen met antibiotica worden gebruikt. Op dit moment kijken de onderzoekers samen met producenten van diervoer en reinigings- en desinfectiemiddelen naar toepassingsmogelijkheden.
Op 3 augustus krijg je nieuwe kado-artikelen.
Als betalend lid lees je zoveel artikelen als je wilt, én je steunt Foodlog











Dank je Dennis voor je geduldige uitleg. Point taken. De (niet) resistentie van bacteriën tegen het chemische antislijm-middel is iets anders dan hun resistentie tegen antibiotica.
De essentiële vraag blijft dan wel of het antislijm-middel echt aspecifiek is en blijft - wat feitelijk het failliet is voor het Leuvense onderzoek - of dat het wél al specifiek is of te maken is voor een of meer ziekmakende bacteriën. Alleen dán kan de Leuvense "vinding" een zinvol wapen zijn/worden tegen de antibiotica-resistentie van bacteriën en is hun niet resistentie tegen het antislijm-middel daarbij inderdaad van groot belang. Jij sluit het specifieke aspect van de Leuvense aanpak in je laatste post overigens niet uit: "... genoemde aanpak niet specifiek lijkt(!) te zijn". De berichtgeving uit Leuven ondersteunt het specifieke kenmerk van hun aanpak denk ik toch al wel:
"Bio-ingenieurs van de KU Leuven hebben aangetoond dat het blokkeren van de slijmproductie van de salmonellabacterie de gemeenschap verzwakt, waardoor ze gemakkelijker verwijderd kan worden. ....". Ik denk ook dat het werken met implantaten gericht op ziekmakende bacteriën het specifieke effect zeer kan faciliteren.
Als ik dan mag kiezen dan ben ik geneigd Leuven het voordeel van de twijfel te geven.
Roland, wat ik zeg is dat de genoemde aanpak - slijm afbreken - niet specifiek lijkt te zijn voor ziekmakende bacteriën. Het kan dus ook gunstige bacteriën flink raken.
Het argument dat resistente bacteriën worden weg-geconcurreerd door niet-resistente soorten slaat op resistentie voor dit middel zelf (dat aanmaak van een slijmlaag verstoord). Als bacterie X resistent is en Y niet, dan zal Y geen bijdrage meer leveren aan het creëren van de slijmlaag. X moet dan al het werk doen, wat veel energie kost. Daardoor zou Y, die geen energie kwijt is aan de aanmaak van slijm, gratis meeliften op het werk van X, en energie overhouden om harder te groeien en uiteindelijk dus X weg te concurreren. Resistentie zegt echter niets over of de betreffende bacterie ziekmakend of gunstig is. Dat verhaal over resistentie zegt dus niets over de effecten op gunstige bacteriën.
Frank Eric, inkapseling in een biofilm (slijmlaag) betekent dat bacteriën minder bloot staan aan antibiotica. Ze zijn bijna niet te raken. Daardoor overleven meer individuele bacteriën de kuur, en is de kans groter dat er een paar tussen zitten die resistentie mechanismen hebben ontwikkeld omdat een deel van de bacteriën wel enigszins blootgesteld zijn.
Resistentie is sowieso een complex verhaal, want antibiotica kan (a) ook resistentie creëren tegen andere antibiotica dan die gegeven is en (b) ook bacteriën doodt die ongevoelig zijn voor de gegeven antibiotica vanwege onderlinge afhankelijkheden tussen verschillende soorten bacteriën. Daardoor heeft zelfs smal-spectrum antibiotica toch best brede gevolgen. Ik vermoed dat dit niet anders of zelfs nog erger zal zijn met de slijmremmer.
Ik begrijp iets niet. Als bacteriën door een beschermlaag afgeschermd zijn van de buitenwereld, hoe kan het dan, dat door die hoge doses antibiotica er daardoor resistentie ontstaat? Als er geen beschermlaagje zou zijn geweest, worden ze dan al niet resistent bij veel lagere doses antibiotica? Maw ga je dan juist niet de resistentieontwikkeling versnellen?
Verder. Als dat slijmlaagje weg is, worden dan ook niet goede bacteriën door antibiotica te grazen genomen? Maw een complete puinhoop in het microbioom?
Op voorwaarde van de generieke werking van het middel op alle bacterien: resistentente zowel als niet resistente. Heeft in dit kader de zinsnede dan geen relevantie dat: ".... de niet-resistente bacteriën de resistente wegconcurreren. De resistente bacteriën zullen namelijk veel harder moeten werken om een slijmlaag van dezelfde proportie te produceren als de niet-resistente bacteriën niet meewerken."?
Duim voor Dennis: ook de 'goede' bacteriën in het maagdarmkanaal vormen een slijmlaag en die willen we natuurlijk niet verstoren, net zo min als de natuurlijke, beschermende mucuslaag op het darmepitheel.